 |  |
Syror och baser är jonlösningar. Flera baser är fasta ämnen som behöver spädas för att bli en jonlösning.
Kort repetition om syror och baser:
pH-skalan mäter hur surt eller basiskt något är. En neutral lösning har pH 7. Lösningar under pH 7 är sura och över pH 7 är basiska. För varje steg på skalan ökar/minskar surheten med gånger 10.
Baser och syror delas upp i starka och svaga baser respektive syror. I starka syror delas alla molekyler upp i joner när de löses med vatten och frigör många vätejoner, H+. Svaga syror delas bara delvis upp till joner vid kontakt med vatten. Samma sak gäller även baser med skillnaden att de frigör hydroxidjoner OH–. Det är stor skillnad i pH mellan svaga och starka syror/baser.
Neutralisation – Blandar du en syra med en bas kommer du att få en neutralisation, d.v.s. att pH-värdet närmar sig 7.
De starka syrornas joner är:
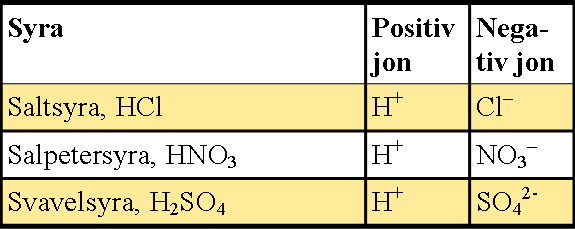
Det är vätejonen, H+ som gör något surt. Ju fler vätejoner, desto lägre pH. På bilden syns hur saltsyra delat upp sig. Det kallas protolys när vätejonen lämnar syran.

Bild: Oskar Uggla / UgglansNO©
I bägaren finns också många vattenmolekyler.
De starka basernas joner är:
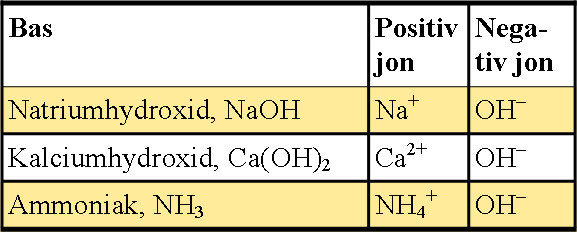
Det är hydroxidjonen, OH–, som gör något basiskt. Ju fler hydroxidjoner, desto högre pH.
Syror kan användas för att skapa salter.
Här är två exempel:
1) Om en syra och en bas blandas kommer vätejonen och hydroxidjonen reagera och bilda vatten. pH-värdet kommer att närma sig 7. Detta kallas neutralisation. Det kommer också att bildas ett salt:
Syra + Bas → Vatten + Salt.
HCl + NaOH → H20 +NaCl (koksalt)
2) Syror löser upp oädla metaller. Hälls syra över en metall bildas vätgas och ett salt.
Syra + Metall → Väte + Salt
2 HCl + Mg → H2 + MgCl2

Bild: Pontus Wallstedt / UgglansNO©
Fördjupning:
- Film – Syror och baser del 1 (Andreas Sandqvist, 10.35, Svenska)
- Film – Syror och baser del 2 (Andreas Sandqvist, 11.27, Svenska)
- Film – Syror och baser del 3 (Andreas Sandqvist, 15.12, Svenska)
- Film – Acids and bases (Ted-Ed, 3.48, Engelska)
- Musik – H2SO4 det blir svavelsyra
- Film – Syror och baser (brom8305, svenska, 13.00)
Uppgifter:
 |  |  |  |  |
Hjälp till att förbättra Ugglans NO! Har du hittat något fel, någon död/olämplig länk eller vill tipsa om någon intressant länk? Skriv en kommentar nedan.

