|  |  |  |  |
SPÄNNINGSSERIEN
 |  |
Elektrokemi handlar om två saker:
1. Att genom kemiska reaktioner få elektrisk ström. I kemiska reaktioner byter elektroner plats och detta fenomen kan utnyttjas för att få en elektrisk ström. Denna händelse används i alla former av batterier.
Bild: Didgeman / Pixabay License
2. Att med hjälp av elektrisk ström starta och driva kemiska reaktioner (kallas också elektrolys). Detta används för att framställa grundämnen (till exempel koppar och aluminium) samt skydda olika metaller mot nedbrytning.
Bild: analogicus / Pixabay License
Kemiska reaktioner som ger elektrisk ström:
Metaller är olika bra på att bilda joner. En del metaller ger ifrån sig sina valenselektroner väldigt lätt medan andra inte gör det. Metaller som ogärna bildar joner kallas ädelmetaller till exempel guld, silver och platina. Metaller som är bra på att bilda joner kallas oädla metaller. Oädla metaller är ofta reaktiva och finns i många olika kemiska föreningar.
Alla metaller kan rangordnas beroende på hur bra de är på att bilda joner. Denna lista kallas spänningsserien. Oftast visas ett urval av metallerna eftersom det är opraktiskt att ta med alla.

Bild: Oskar Uggla / UgglansNO
De oädla metallerna befinner sig längst till vänster och de ädla finns längst till höger. Observera att väte finns med i spänningsserien.
I naturen existerar väte till exempel som vätgas (H2) och som vätejoner (H+). Vätejoner finns i syror. I spänningsserien kommer de metaller som står till vänster om väte (oädlare) att lösas upp av vätejoner och de till höger om väte (ädlare) kommer inte att göra det.
Bilden nedan visar ett magnesiumband som lagts i en bägare med en syra. Vätejonerna i syran snor elektroner från magnesiumet och bildar vätgas. Vätgasen skapar bubblor. Magnesiumet löses upp och bildar magnesiumjoner.
Fördjupning:
- Film – Elektrokemi (Andreas Sandqvist, svenska, 9.31)
- Film – Den elektrokemiska spänningsserien (Magnus Ehinger, svenska, 13.10)
- Hemsida – Elektrokemi (se)
Uppgifter:
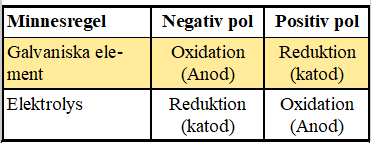
OXIDATION REDUKTION
 |  |
Oxidation och reduktion är två händelser som handlar om elektroner som byter plats i en kemisk reaktion. Vid en kemisk reaktion inträffar alltid både oxidation och reduktion.
Exempel 1:
Bilden nedan visar en bägare med saltet kopparklorid (CuCl2) som har lagts i en bägare med vatten. Vattnet i bägaren kommer att dela upp saltet i positiva och negativa joner (Cu2+ och Cl–). Den blå färgen är typisk för kopparsalter. I mitten av bägaren ligger stålull som består av rent järn (Fe). De negativa jonerna har ingen funktion i detta exempel så de lämnas utanför.

Bild: Oskar Uggla / UgglansNO
Båda metalljonerna vill ha fullt yttersta elektronskal men eftersom kopparjonerna är mer ädla än järnjonerna kommer de att stjäla elektroner från järnet.

Bild: Oskar Uggla / UgglansNO
Kopparjonerna bildar koppar och lägger sig som en beläggning på järnet. Järnet kommer att bilda järnjoner och stålullen upplöses. På lösningens färg syns det att något hänt. Kopparkloridens karaktäristiska ljusblå färg är borta.
Två reaktioner äger rum:
1) Kopparjoner blir koppar (reduktion).
2) Järnet blir järnjoner (oxidation).
Oxidation
Oxidation är en reaktion där det avges elektroner. I detta fall är det järn som avger elektroner. Järnet oxideras.
Fe → Fe2+ + 2e–
Järn → Järnjoner + 2 elektroner
Reduktion
Reduktion är en reaktion där elektroner tas upp. I detta fall är det kopparen som tar upp elektroner. Kopparen har reducerats.
Cu2++ 2e– → Cu
För att kunna ta emot elektroner måste ett annat grundämne ge ifrån sig sina elektroner. Därför äger alltid oxidation och reduktion rum samtidigt. Det kallas för en redox-reaktion och vanligtvis skrivs de två reaktionerna i samma formel (utan elektroner).
Fe + Cu2+→ Cu + Fe2+
En redox-reaktion är ett exempel på elektroner i rörelse. Elektricitet är just elektroner i rörelse. I ett batteri omvandlas den kemiska energin till elektrisk energi.
Exempel 2:
Läggs en kopparbit i en lösning med järnjoner händer ingenting eftersom kopparen inte vill lämna ifrån sig elektroner till järnet på grund av att järnet är en oädlare metall.
- Film – Magnus Ehinger: Oxidation och reduktion (youtube, svenska, 9.16)
Uppgifter:
GALVANISKA ELEMENT
 |  |
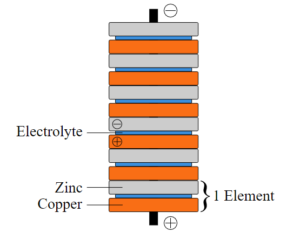
Ett galvaniskt element är ett samlingsnamn för olika typer av batterier. I galvaniska element omvandlas kemisk energi till elektrisk energi.
Ett galvaniskt element är en konstruktion med två olika metaller i en jonlösning. Mellan metallerna är en ledare kopplad så att elektroner kan vandra emellan. I galvaniska element kallas jonlösningen för elektrolyt.
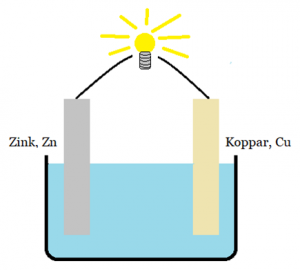
Bild: Oskar Uggla / UgglansNO
Trots att båda metallerna har fullt yttersta elektronskal kommer kopparen (mer ädel) att stjäla elektroner från zinken. Det kommer att åka elektroner i ledaren och en ström uppstår. Strömmen kan få till exempel en lampa att lysa.
.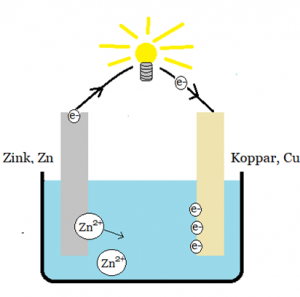
Bild: Oskar Uggla / UgglansNO
Koppar som tar emot elektroner blir en positiv pol och zink som avger blir en negativ. En minnesregel kan vara att zink avger elektroner eftersom den har så många och därför är den en negativ pol.
Zinken oxideras (avger elektroner) och zinkjonerna går ut i jonlösningen (elektrolyten).
Zn(s) → Zn2+ + 2e−
(s står för solid = zink i fast form)
Kopparbiten borde då reduceras men det gör den inte. Kopparen har egentligen inget behov av elektroner eftersom de har fulla yttersta elektronskal. Elektroner ger kopparbiten en negativ laddning vilket gör att positiva joner i lösning dras till kopparbiten, reduceras på dess yta och bildar en beläggning på den. Om finns kopparjoner i lösningen så reduceras de.
Cu2++ 2e− → Cu (s)
Den pol där det sker oxidation kallas för anod och den pol där reduktion sker kallas katod. Minnesregeln för galvaniska element är PKNA. Positiv pol = Katod, Negativ pol = Anod
Det finns många faktorer som påverkar hur stor strömmen blir. Vilka metaller man har, hur stora de är, hur nära de sitter varandra samt hur mycket joner det finns i jonlösningen, med mera.
Ett galvaniskt element som har haft stor betydelse för utvecklingen av batterier är Daniells cell.
Fördjupning:
Uppgifter:
KORROSION
 |  |
Korrosion innebär att en metall löses upp genom en kemisk reaktion. Vanligtvis reagerar metall med syre och bildar då metalloxider. Utomhus går reaktionen snabbare och det händer olika saker beroende på metall. Några exempel:
- Järn rostar till olika varianter av järnoxid. Järnoxid är poröst och har det väl börjat rosta går det ganska snabbt för resten av järnet att reagera.
- När aluminium reagerar med syre får metallen en hinna av aluminiumoxid. Detta lager skyddar mot många reaktioner till exempel med syre vilket gör att aluminium håller sig fint länge så släng därför inga aluminiumburkar i naturen.
Bild: DEZALB / Pixabay License
- Koppar ärgar och blir vackert grön. Tänk på hur fina gamla kyrktak kan vara. Det kallas ärga när koppar reagerar med luftens syre och bildar ett lager kopparoxid på metallens yta. Likt exemplet ovan med aluminium skyddar den metallen mot fler reaktioner. Det tar det lång tid för kopparen att brytas ner i naturen.
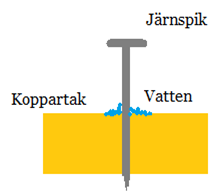
Bild: Oskar Uggla / UgglansNO
Om metaller blandas är det möjligt att omedvetet bygga galvaniska element som gör att metaller löses upp (korroderar). Ett klassiskt exempel är att använda järnspik för att spika ett koppartak. Regnvattnet kommer bli en jonlösning. Det gör att järnet (som är oädlare än koppar) kommer avge elektroner till kopparen och järnet försvinner iväg som joner. Järnet löses upp.
För att skydda sig mot korrosion orsakad av elektrokemi sätts oädla metaller dit på utsatta metallföremål.
Bild: Bros / Creative Commons 3.0 International
Ungefär 3,5 procent av havsvattnet består av joner. Det gör havsvattnet till en jonlösning. En metallbåt kommer alltid riskera att korrodera när ädlare joner snor elektroner från båtens skrov. Därför sätts en väldigt oädel metall fast i skrovet till exempel magnesium. Magnesiumet kommer att lösas upp i första hand. Magnesiumet kallas offeranod. När det sedan är slut får man sätta dit nytt. Denna typ av skydd används också när metalltankar grävs ner i jorden, till exempel på bensinstationer.
Ytterligare ett sätt att skydda metaller som lätt reagerar med syre är att dra över ett lager med en metall som är mindre reaktionsbenägen. Till exempel doppas järnspikar i flytande zink. Det kallas för att de varmförzinkas.

Fördjupning:
- Film – Korrosion (Magnus Ehinger, 6.08, svenska)
- Film – Corrosion of metals (Fuseschool, engelska, 2.52)
- Film – What is corrosion and how to stop it (GCSE Chemistry, engelska, 6.19)
- Film – Rust: Preventation & Treatment (Fuseschool, engelska, 4.51)
- Film – Corrosion and rust (elearnin, engelska, 2.14)
- Film – Varför rostar järn och hur kan man förhindra det? (Le3scienteers, svenska, 9.03)
Uppgifter:
ELEKTROLYS
 |  |
Elektrolys innebär att starta och driva kemiska reaktioner med elektricitet. Detta används för att framställa grundämnen (till exempel koppar och aluminium) samt för att skydda olika metaller mot nedbrytning (korrosion).
Till elektrolys behöver du två stavar som leder ström (metall- eller kolstavar) och en jonlösning. Stavarna kallas elektroder och jonlösningen elektrolyt. Det behövs också en strömkälla med likström. Det innebär att strömmen går i samma riktning hela tiden. På bilden visas en enkel uppställning.
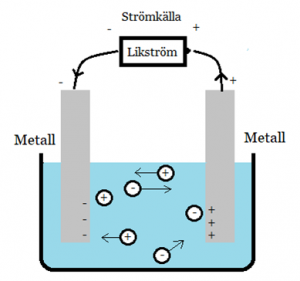
Bild: Oskar Uggla / UgglansNO
När en spänning läggs på, kommer i det här fallet den vänstra elektroden bli en minuspol och den högra en pluspol. De positiva jonerna dras till minuspolen och de negativa jonerna till pluspolen. Oxidation sker vid den positiva polen som kallas anod. Reduktion sker vid den negativa polen som kallas katod. Detta är tvärtom jämfört med galvaniska element. Minnesregeln för elektrolys är PANK. Positiv pol = Anod, Negativ pol = Katod
För både elektrolys och galvaniska element sker oxidationen vid anoden och reduktionen vid katoden.
Jonerna i jonlösningen lägger sig ofta som en beläggning på elektroderna. Bildas det gas bubblar det vid den elektroden. Om det bildas alkalimetaller, till exempel natrium, reagerar den genast med vattnet i jonlösningen och gör det basiskt.
Bild: Oskar Uggla / UgglansNO
Eftersom det finns en strömkälla som driver den kemiska reaktionen är det viktigt att elektroderna leder elektricitet bra. Därför är de båda ofta gjorda av koppar. Ibland finns det risk för att kopparelektroden oxideras d.v.s. att den själv blir till joner och vandrar ut i elektrolyten. Då kan man byta ut dem mot kolelektroder istället. Kol har molekylbindning och håller hårdare i sina elektroner. (Kopparen har metallbindning).
Med hjälp av elektrolys är följande möjligt:
- Att sortera jonerna i en jonlösning eftersom de åker till olika poler. Detta sker vid framställning av vissa metaller. Det går också att framställa gaser.
- Det går att lägga metallbeläggningar på andra metallföremål. Det kallas för att galvanisera och skyddar metaller som lätt korroderar till exempel spikar.
Fördjupning:
- Film – Electrolysis of molten compounds (Fuseschool, engelska, 4.04)
- Film – Electrolysis of water (Fuseschool, engelska, 4.07)
Uppgifter:
BATTERIER
 |  |
Alessandro Volta var en italiensk fysiker och kemist som levde på 1700-talet. Han tillverkade ett av de första kända exemplen på ett galvaniskt element, Voltas stapel. Volta staplade många plattor av zink och silver i lager och hade svavelsyra som elektrolyt. Denna kombination seriekopplade han och kom upp i drygt 100 volt.
Bild: Luigi Chiesa / CC BY-SA 3.0
Idag finns det många olika typer av batterier. Beroende på vilka metaller och vilken typ av jonlösning som används blir batterier olika effektiva och kostar olika mycket att tillverka.
Bild: fotoblend / Pixabay License
I mitten av 1800-talet uppfanns ett batteri med metallen zink som minuspol och jonföreningen manganoxid som pluspol. Elektrolyten var salmiak. Manganoxid kallas också för brunsten och denna typ av batterier kallas brunstensbatterier. Idag är ett slags brunstensbatteri, det alkaliska batteriet, den absolut vanligaste batteritypen. De går inte att ladda upp och kallas AA eller AAA-batterier. De har en spänning på 1,5 volt.

En dyrare batterityp som också räcker längre är litiumbatterier. De sitter i mobiltelefoner, bärbara datorer och annan modern teknisk utrustning. Ett litiumbatterie ger dubbelt så hög spänning som ett brunstensbatteri och går att ladda upp.
Alla batterier ska lämnas in på en miljöstation när de tagit slut men några är extra miljöfarliga:

- Knappscellsbatterier innehåller kvicksilver som är mycket giftigt.
Bild: Alexei_other / Pixabay License
- Gamla laddningsbara batterier innehåller också giftiga grundämnen som kadmium.
Bild: jpj2000nl / Pixabay License
- Bilbatterier innehåller stora mängder bly.
Batterier som går att ladda upp kallas ackumulatorer. När de laddas upp används elektricitet för att få den kemiska processen i batteriet att gå baklänges.
Fördjupning:
- Film – Batterier (Mona Sohlman, svenska, 2.35)
- Film – Batteriet (Naturlikt.se, svenska, 4.42)
- Film – How batteries work (Ted-Ed, 4.20, Engelska)
- Film – The world´s biggest battery (Ted-Ed, 5.16, Engelska)
- Film – 4 incredible tricks with batteries (Jlaservideo, engelska, 10.03)
Uppgifter:
 ———————————————————————————————–
———————————————————————————————–
 |  |  |  |  |