|  |
I en kemisk reaktion reagerar kemiska ämnen med varandra och bildar ett nytt kemiskt ämne. A + B => C. Inga atomer försvinner eller tillkommer vid en reaktion utan de byter bara plats med varandra så att nya kombinationer bildas. Till exempel kol reagerar med syre och då bildas kolmonoxid. När reaktionen är klar finns bara kolmonoxid. Allt kol och syre är omvandlat.
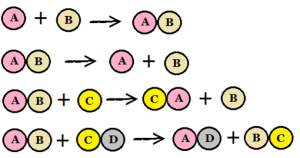
Bild: Oskar Uggla / UgglansNO
Kemiska reaktioner sker hela tiden överallt. En del reaktioner går blixtsnabbt till exempel explosioner medan andra tar väldigt lång tid på sig till exempel när järn rostar.
Vad påverkar reaktionshastigheten?
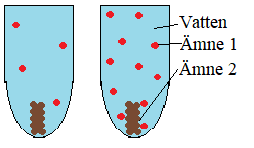
Bilden nedan visar två ämnen som reagerar med varandra i ett provrör med vatten. Vattnet reagerar inte utan hjälper bara ämne 1 och ämne 2 att stöta på varandra.
Koncentration – Om koncentrationen av ett eller fler av ämnena är hög kommer reaktionen gå snabbare. Det beror på att det finns fler aktiva atomer som kan stöta ihop med varandra och reagera.
Bild: Oskar Uggla / UgglansNO
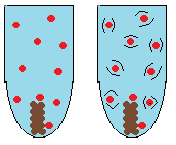
Finfördelning – Ämnen som är uppdelade i småbitar reagerar snabbare med varandra. Reaktionen sker där ämnena har kontakt med varandra. Smulas ett ämne sönder till småbitar eller till pulver har det en mycket större area som kan komma i kontakt med det andra ämnet. Har ämnena större kontaktyta har de enklare att stöta på varandra och reagera.
Bild: Oskar Uggla / UgglansNO
Temperatur – Ju högre temperatur ett ämne har desto mer rör sig dess atomer. Ju snabbare atomerna rör sig desto större chans att stöta ihop med något annat ämne och reagera med.
En katalysator är ett kemiskt ämne som påskyndar en kemisk reaktion utan att själv förbrukas. Alla kemiska reaktioner har inte en katalysator och olika reaktioner (av de som kan påskyndas) har olika katalysatorer.
När ämnen reagerar med varandra frigörs nästan alltid värme (vid 95% av reaktionerna). Det innebär att de ämnen som reagerar innehåller mer energi än det som bildats. En av drivkrafterna till att ämnen spontanreagerar med varandra är att bilda energifattigare föreningar. Dessa reaktioner kallas exoterma .Till exempel när ved brinner. Eftersom ved är energirikare än aska.
Motsatsen kallas endoterm reaktion. Då kommer det bildas energirikare ämnen än vad som fanns från början. Vid dessa reaktioner tas värme upp från omgivningen. Värmen lagras som kemisk energi.
Fördjupning:
- Film – Top 10 Chemical reactions (Dailytop20s, engelska, 10.38)
- Film – 6 chemicals reactions that change history (It´s ok to be smart, engelska, 7.55)
- Film – Endothermic and exothermic reactions (Bozeman Science, engelska, 4.34)
- Film – Amazing chemicals reactions! (Youtube, engelska, 4.11)
- Film – Why do chemical react? (Ted-Ed, 3.46, Engelska)
- Film – How to speed up chemical reactions. (Ted-Ed, 4.56, Engelska)
Uppgifter:
 |  |  |  |  |
Hjälp till att förbättra Ugglans NO! Har du hittat något fel, någon död/olämplig länk eller vill tipsa om någon intressant länk? Skriv en kommentar nedan.