 |  |
Ett galvaniskt element är ett samlingsnamn för olika typer av batterier. I galvaniska element omvandlas kemisk energi till elektrisk energi.
Ett galvaniskt element är en konstruktion med två olika metaller i en jonlösning. Mellan metallerna är en ledare kopplad så att elektroner kan vandra emellan. I galvaniska element kallas jonlösningen för elektrolyt.
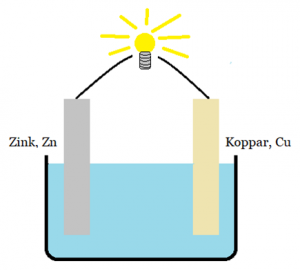
Bild: Oskar Uggla / UgglansNO
Trots att båda metallerna har fullt yttersta elektronskal kommer kopparen (mer ädel) att stjäla elektroner från zinken. Det kommer att åka elektroner i ledaren och en ström uppstår. Strömmen kan få till exempel en lampa att lysa.
.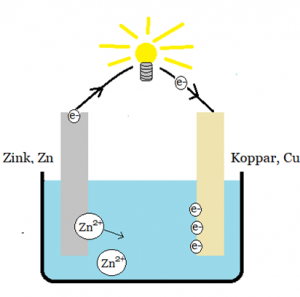
Bild: Oskar Uggla / UgglansNO
Koppar som tar emot elektroner blir en positiv pol och zink som avger blir en negativ. En minnesregel kan vara att zink avger elektroner eftersom den har så många och därför är den en negativ pol.
Zinken oxideras (avger elektroner) och zinkjonerna går ut i jonlösningen (elektrolyten).
Zn(s) → Zn2+ + 2e−
(s står för solid = zink i fast form)
Kopparbiten borde då reduceras men det gör den inte. Kopparen har egentligen inget behov av elektroner eftersom de har fulla yttersta elektronskal. Elektroner ger kopparbiten en negativ laddning vilket gör att positiva joner i lösning dras till kopparbiten, reduceras på dess yta och bildar en beläggning på den. Om finns kopparjoner i lösningen så reduceras de.
Cu2++ 2e− → Cu (s)
Den pol där det sker oxidation kallas för anod och den pol där reduktion sker kallas katod. Minnesregeln för galvaniska element är PKNA. Positiv pol = Katod, Negativ pol = Anod
Det finns många faktorer som påverkar hur stor strömmen blir. Vilka metaller man har, hur stora de är, hur nära de sitter varandra samt hur mycket joner det finns i jonlösningen, med mera.
Ett galvaniskt element som har haft stor betydelse för utvecklingen av batterier är Daniells cell.
Fördjupning:
- Artikel – Allt om vetenskap: Voltas stapel
Uppgifter:
 |  |  |  |  |
Hjälp till att förbättra Ugglans NO! Har du hittat något fel, någon död/olämplig länk eller vill tipsa om någon intressant länk? Skriv en kommentar nedan.

