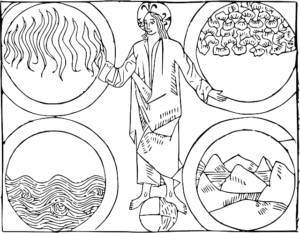|  |  |  |  |
V AD ÄR KEMI?
 |  |
Kemi handlar om ämnen och material vi har runt omkring oss, hur de är uppbyggda och hur de påverkar varandra. Alla föremål är kemi, oavsett om föremålen är tillverkade eller förekommer naturligt. Du är kemi.
Kemi handlar även om att beskriva ämnens olika egenskaper till exempel lukt, färg, pH, kokpunkt, om ämnet leder ström och värme, vattenlöslighet m.m. Kemi handlar om vad som händer när ämnen blandas och reagerar med varandra samt bildar nya ämnen.
Bild: crsssteve/Pixabay License
Kunskapen om kemi har använts sedan forntiden. Grekiska filosofer (bl. a. Aristoteles) införde teorin om att alla ämnen bestod av olika halter av de fyra grundläggande elementen: jord, luft, eld och vatten. Denna teori var inte byggd på vetenskap utan på filosofi eftersom ”vetenskapsmännen” inte experimenterade. En annan forntida grek, Demokritos hade en teori om att världen var uppbyggd av små byggstenar som han kallade atomos. Han var också en filosof (gjorde inga experiment) men hade väl lite tur eftersom han träffade ganska rätt i jämförelse med dagens teorier.
Bild: Clker-Free-Vector-Images/Pixabay License
Den typ av kemi som fanns innan den moderna kemins genombrott på 1700-talet kallas alkemi. Två av de starka drivkrafter som drev alkemisterna var drömmen om att tillverka ”de vises sten”. De vises sten är någon form av mirakelmedel som skulle kunna göra guld av andra metaller, bota sjuka och ge evigt liv. Denna önskan uppfylldes inte men på vägen till detta misslyckande upptäckte ”vetenskapsmännen” många kemiska ämnen och effektiva arbetsmetoder som lade grunden till den moderna kemin.
Den moderna kemin började på 1700-talet genom införandet av det naturvetenskapliga arbetssättet. Det innebär att en hypotes formuleras vilken sedan bevisas genom ett experiment eller någon annan form av undersökning. Experimentet ska sedan kunna upprepas och ge samma resultat. Utifrån resultatet kan sedan en slutsats dras som ger nya kunskaper.
Fördjupning:
- Film – Ämnens egenskaper (Andreas Sandqvist, 8.53, Svenska)
- Film – Naturvetenskapligt arbetssätt (Ida Peters, svenska, 7.08)
Uppgifter:
KEMIHISTORIA
 |  |
Många upptäckter och uppfinningar har gjorts i historien utan att människorna har haft den kemiska kunskapen bakom. I forntiden (3000– 2000 år f.Kr) upptäcktes och framställdes rena metaller (tenn, koppar och järn). Glas och keramik tillverkades och kroppar balsamerades. Kunskapen om materialen i kläder, byggnadsmaterial och skrivmaterial är också kemi.
Den moderna kemins historia började under slutet av 1700-talet när fransmannen Antoine Lavoiser upptäckte ”lagen om massans bevarande”. Det innebär att när en kemisk reaktion sker i ett avgränsat rum kommer ämnenas vikt före reaktionen vara lika stor som ämnenas vikt efter reaktionen.
John Dalton och svensken Jöns Jacob Berzelius arbetade, i början av 1800-talet, med att beräkna förhållandet mellan de olika grundämnenas vikt. Ett viktigt arbete för teorin om att allting bestod av atomer.

Bild: Pontus Wallstedt / UgglansNO
Många grundämnen upptäcktes under 1700– och 1800-talet genom analys av olika ämnen (analys = ta isär) och kemister lärde sig att tillverka nya kemiska ämnen genom syntes (syntes = sätta ihop). Sverige gjorde en stor insats under denna tid för kemins utveckling. 23 av de 94 grundämnena som naturligt förekommer har upptäckts av svenskar.
Betydelsefulla svenskar inom kemin:
- Jöns Jakob Berzelius kallas den svenska kemins fader. Han är upphovsmannen bakom att de kemiska tecknen skrivs med en eller två bokstäver.
- Carl Wilhem Scheele. Han upptäckte flera grundämnen och viktiga kemiska föreningar. Till exempel klor och syre.
- Svante Arrhenius. Han fick Sveriges första Nobelpris i kemi och arbetade mycket med kemin inom fysiken.
Totalt har svenskar fått Nobelpriset i kemi fem gånger, fyra i fysik och åtta gånger i medicin.
Viktiga kemiska upptäckter gjorda av svenskar.
De kemiska kunskaperna ledde till uppfinningar inom många skilda områden. Till exempel inom material, medicin och förklaringar till fysiska- och biologiska händelser. Några viktiga svenska uppfinningar är dynamiten, säkerhetständstickan och magmedicinen Losec som på 90-talet var världens mest sålda läkemedel.
Bild: 024-657-834/Pixabay License
Fördjupning:
- Film – Naturvetenskapens historia del 1 (Andreas Sandqvist, 9.17, Svenska)
- Film – Naturvetenskapens historia del 2 (Andreas Sandqvist, 8.21, Svenska)
- Artikel – De fyra elementen (Ny teknik)
- Film – Antoine Lavoisier and the origin of modern chemistry (Openmind, engelska, 4.41)
- Film – Svante Arrhenius (Urplay, 18.00, svenska)
Uppgifter:
KEMISÄKERHET
 |  |
Dessa regler gäller vid laboration i en NO-sal. Din kemilärare kommer också informera dig innan laborationen vilka säkerhetsregler som gäller för den aktuella laborationen.
Allmänt i kemisalen:
- Du får inte äta eller dricka i en NO-sal.
- Inga kemikalier för vidröras (använd sked) med händerna om du inte vet att de är ofarliga. Om du skulle få kemikalier på huden, i mun eller ögon meddela genast din lärare.
- Smaka aldrig på en kemikalie.
- I salen ska du veta var det finns: brandsläckare, förbandslåda, brandfilt, nöddusch och ögondusch.
- Det är förbjudet att springa och stöka runt i en NO-sal.
Innan du laborerar
- Lyssna noga på din lärares instruktioner.
- Ta på skyddsutrustning (skyddsförkläde och skyddsglasögon) om det behövs.
- Ytterkläder och väskor får inte vara i närheten av laborationen. Häng dem i ditt skåp eller på en plats som din lärare visar dig.
- Om du arbetar med eld och har långt hår, sätt då upp håret.
- Börja alltid laborationen med att läsa igenom instruktionerna så du vet vad du ska göra.
- Stå gärna upp när du laborerar.
När du laborerar:
- Följ instruktionerna och hitta inte på något eget experiment utan att fråga din lärare först.
- Håll rent omkring dig.
- Häll aldrig tillbaka en kemikalie i den flaska eller burk du tog den ur. Om du tagit för mycket dela med dig till en annan elev.
- Var uppmärksam på din omgivning så att du inte råkar stöta ihop med någon eller utsätter någon för fara på annat sätt.
Efter laborationen:
- Städa undan och diska ordentligt. Ställ tillbaka utrustningen där du tog dem. Torka av bänken om det behövs.
- Häll inte kemikalier i vasken utan att fråga din lärare.
- Tvätta händerna om det behövs.
Farosymboler – På alla kemiska produkter som anses farliga finns det en eller flera symboler. Dessa ska du känna till:

Fördjupning:
- Film – Utrustning (Studi, 4.27, Svenska)
- Film – Säkerhet i NO-salar (Eva bjerding, svenska, 2.27)
Uppgifter:
ATOMEN
 |  |
Naturens byggstenar kallas atomer. Det finns 94 olika naturligt förekommande atomsorter och ytterligare 24 som är tillverkade i laboratorium. Varje unik atomsort kallas grundämne. Allt som finns omkring dig är uppbyggt av atomer.
Du kan jämföra atomer med din legosamling hemma. Varje unik legobit motsvaras av ett grundämne. Du kan med hjälp av olika legobitar bygga olika modeller. Du kan plocka isär modellen och bygga upp något nytt med samma bitar.
Naturen bygger upp universum med hjälp av olika grundämnen och använder samma atomer om och om igen. De atomer som du består av har använts många gånger förut i andra kombinationer.

Bild: Pontus Wallstedt / UgglansNO
Atom betyder odelbar eftersom den grekiske filosofen Demokritos som först hittade på begreppet atom, ansåg att atomen var odelbar.
Idag vet vetenskapen att atomen består av mindre delar. Atomens delar:
- Protoner – Positivt laddade. Finns i atomkärnan.
- Neutroner – Neutralt laddade. Finns i atomkärnan.
- Elektroner – Negativt laddade. Åker runt atomkärnan i elektronskal.
En atom är väldigt liten och består till största delen av ingenting. Om atomkärnan vore stor som en golfboll skulle de första elektronerna cirkulera runt kärnan ungefär en kilometer bort.
Grundämnen har olika egenskaper till exempel storlek, vikt m.m. Grundämnena är indelade i grupperna : metaller, halvmetaller och ickemetaller. De flesta grundämnen tillhör gruppen metaller (80%). För att få kalla sig metall måste grundämnet leda ström och värme, glänsa och kunna smidas. Exempel på vanliga metaller är järn, aluminium och koppar.
Bild: macayran/Pixabay License
Grundämnen har olika antal protoner, neutroner och elektroner. Det är antalet protoner som gör att det blir ett unikt grundämne. I syre har atomen åtta protoner men i kväve har den sju stycken. Både antalet neutroner och elektroner kan variera utan att det blir ett annat grundämne.
En kemisk förening är ett ämne som består av flera olika grundämnen som sitter ihop. De allra flesta kemiska ämnen människan känner till är kemiska föreningar. En kemikalie är en kemisk förening som är tillverkad av människor. Ett exempel på en kemikalie är tvättmedel, godis och bensin.
Kemiska tecken – Alla grundämnen har en förkortning, ett kemiskt tecken. Det kemiska tecknet är unikt för varje grundämne och består av en stor bokstav eller en stor bokstav med en liten efter. I ett periodiskt system finns grundämnena och deras kemiska tecken samlade.
Fördjupning:
- Film – Atomens delar (Studi, 3.59, Svenska)
- Hemsida – Atomer (naturkunskap.org)
- Film – The scale of universe 2 (caykh, engelska, 3.23)
- Film – Ted-ed: Just how small is an atom? (youtube, engelska, 5.27)
- Film – What is the shape of a molecule (Ted-Ed, 3.48, Engelska)
- Film – Just how small is an atom? (Ted-Ed, 5.28, Engelska)
- Film – Atomer (Urplay, 2.31, svenska)
- Film – What is a molecule? (Stated Clearly, 8.18, Engelska)
- Film – What are atoms made of? (Stated Clearly, 7.37, Engelska)
- Film – What is an atom and how do we know? (Stated Clearly, 12.15, Engelska)
Uppgifter:
PARTIKELMODELLEN
 |  |
En partikel är något väldigt litet. En partikel kan vara del av något till exempel en proton i atomen, en molekyl eller sot i atmosfären.
När en händelse förklaras utifrån att atomerna är små partiklar kallas det partikelmodellen. De begrepp som är viktiga vid dessa förklaringar är:
Densitet:– Alla ämnen har en densitet. Densitet mäter hur kompakta ämnen är. Ett ämne med hög densitet, till exempel en metall, är mer kompakt. Ett ämne med låg densitet kan vara en gas. En annan beskrivning är att densitet är ett ämnes täthet. Ju högre densitet som ett ämne har desto mer massa trängs på samma volym.
Järn har hög densitet. Gaser har låg densitet. På bilden nedan är kuberna lika stora men de väger ändå olika mycket. De har alltså olika densitet.

BiId: Pontus Wallstedt / UgglansNO
Temperatur är ett mått på atomernas rörelse. Ju högre temperatur ett ämne har desto mer rör sig atomerna i det. När atomerna rör sig mer tar de större plats (kräver mer volym). Temperaturen avgör vilken fas eller aggregationsform ämnet har. Alla grundämnen (och de flesta kemiska föreningar) har tre olika faser/aggregationsformer som de kan befinna sig i: fast form, flytande form och gasform.
Om ämnen reagerar med varandra och bildar nya kemiska föreningar kallas det för en kemikalisk förändring. När ämnen byter fas är det exempel på en fysikalisk förändring. Det är samma ämne, men i en annan form.
- Fysikalisk förändring: Du tappar ett äpple från ett fönster. Äpplet blir mos (ändrar form) men det är fortfarande ett äpple.
- Kemikalisk förändring: Du låter det mosade äpplet ligga kvar på marken. Det börjar reagera med luftens syre och brytas ner.
Exempel på en förklaring med partiklar:
Du sitter högst upp i en bastu och det är väldigt varmt. Plötsligt kommer någon in och häller vatten på bastuaggregatet. Nu blir det så varmt att du storknar och går ut. Varför känns det varmare? Jo, i bastun finns ett visst antal luftmolekyler (kväve, syre, m.m.) Dessa har stor rörelse eftersom det är hög temperatur i bastun. När luftmolekylerna träffar din kropp övergår deras rörelseenergi till värme. Dock är det inte så många molekyler. När vatten hälls på aggregatet omvandlas vattnet till vattenånga. Nu finns det betydligt fler partiklar (vattenmolekyler) i bastun som krockar med din kropp och gör att det blir varmare.
Bild: monika1607 / Pixabay License
Fördjupning:
- Film – Ämnen kan förändras (Andreas Sandqvist, 4.37, Svenska)
- Film – Tillstånd och faser för ett ämne (Schoolido, Svenska, 1.14)
- Film – Fasövergångar (Studi, 0.50, Svenska)
Uppgifter:
BLANDNINGAR
 |  |
När grundämnen eller kemiska föreningar reagerar med varandra bildas nya ämnen (A+B = C). Ämnen kan också blandas med varandra. Då bildas inga nya ämnen utan allt ursprungligt finns kvar. En blandning ska kunna delas upp i sina ursprungliga delar. Nedan beskrivs olika typer av blandningar:
Lösning – När ett fast ämne blandas i en vätska och löser upp sig. I en lösning kan koncentrationen skilja sig åt. Häller du i mer av det fasta ämnet i vätskan blir den mer koncentrerad. Häller du i mer vätska blir den utspädd. Om du inte kan lösa mer av det fasta ämnet i vätskan är den mättad. Till exempel om du har väldigt mycket socker i ditt te kommer det samlas en gegga på botten av koppen. Lösningen är då mättad.

Bild: Pontus Wallstedt / UgglansNO
En lösning med ett ämne i men utan gegga på botten kallas omättad. Det innebär att du kan lösa mer fast ämne i vätskan. Ju varmare vätskan är desto mer fast ämne kan du lösa.

Uppslamning – Ett fast ämne i en vätska. Det fasta ämnet består av lite större partiklar som flyter runt i vätskan. Om du låter denna blandning stå en stund kommer partiklar att lägga sig på botten i den behållare blandningen förvaras i. Exempel är juice med fruktkött i och vattenfärger.
Bild: Oskar Uggla / UgglansNO
Emulsion – Vatten och olja är olika typer av vätskor. De löser sig inte med varandra utan lägger sig på varandra, i lager. Men om du skakar en sådan blandning kommer oljan att bilda små droppar som flyter runt i vattnet. Detta kallas emulsion. Väntar du ett tag kommer oljan åter att lägga sig på toppen eftersom den har lägre densitet. Exempel på emulsioner är mjölk (några procent fett) och salladsdressing med olja och vinäger.
Bild: Alexas_Fotos/Pixabay License
Legering – Blandning av två eller fler sammansmälta metaller. Metaller smälts samman för att få fram bättre egenskaper. Legeringar är väldigt vanliga. Alla svenska mynt är legeringar.
Bild: chezbeate / Pixabay License
Aerosol – Små partiklar (fasta eller flytande) som är lösta i en gas. Exempel är rök, sprayfärg, dimma (vattenmolekyler lösta i luft) och olika typer av luftföroreningar exempel på aerosoler. Många mediciner som inhaleras (andas in) är aerosoler.
Fördjupning:
- Film – Andreas Sandqvist: Rena ämnen och blandningar (youtube, svenska, 9.34)
- Film –: Blandningar laboration (studi.se, svenska, 4.37)
- Hemsida – Vad är en blandning? (naturvetenskap.org)
- Hemsida – Wikipedia: Lista över legeringar
- Film – Grundämnen och kemiska föreningar (Magnus Ehinger, 10.40, svenska)
Uppgifter:
SEPARERA BLANDNINGAR
 |  |
Att separera blandningar innebär att de delas upp i sina ursprungliga delar. Här nedan presenteras några vanliga separationsmetoder.
Bild: pixel2013 / Pixabay License
Filtrera – används för att skilja ett fast ämne från en vätska. Vanligt är att filterpapper används där de fasta partiklarna fastnar medan vätskan åker igenom. Ett exempel på filtrering är när man brygger kaffe och använder ett kaffefilter.
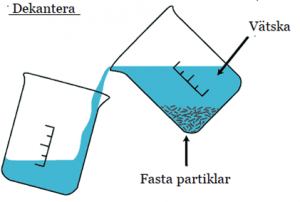
Bild: Pontus Wallstedt / UgglansNO
Sedimentera – Att låta fasta partiklar i en vätska sjunka till botten till exempel i en uppslamning kallas att sedimentera lösningen. Sedan hälls vattnet av. Att hälla av en vätska på detta sätt kallas för att dekantera.
Indunstning – Denna metod används för att separera ett fast ämne som är löst i en vätska. Vätskan tas inte till vara på. Vattnet dunstar bort och kvar blir ämnet som var löst i vattnet.

Bild: Pontus Wallstedt / UgglansNO
Destillera – Detta används för att skilja ett löst ämne från en vätska. Till exempel när man vill få bort salt från saltvatten och på så sätt tar vara på vattnet (viktigt i länder med vattenbrist).
Vattnet kokas så att det förångas (1). Vattenångan stiger (2) och samlas upp med hjälp av ett rör (3) till ett annat kärl (4). Saltet blir kvar i det ursprungliga kärlet.
Bild: Istock
Centrifugera – Olika stora (alternativ tunga molekyler) skiljs från varandra genom att lösningen roteras i en centrifug, likt en karusell. Tunga och lätta molekyler påverkas olika mycket av snurrandet och därför skiljs de åt.
Fördjupning:
- Film – Andreas Sandqvist: Separationsmetoder (youtube, svenska, 5.44)
- Hemsida – Separationsmetoder (naturvetenskap.org)
- Film – Destillation (Eva Bjerding, svenska, 1.26)
- Film – How do we separate the seemingly inseparable? (Ted-Ed, 4.24, Engelska)
Uppgifter:
KEMISKA REAKTIONER
 |  |
I en kemisk reaktion reagerar kemiska ämnen med varandra och bildar ett nytt kemiskt ämne. A + B => C. Inga atomer försvinner eller tillkommer vid en reaktion utan de byter bara plats med varandra så att nya kombinationer bildas. Till exempel kol reagerar med syre och då bildas kolmonoxid. När reaktionen är klar finns bara kolmonoxid. Allt kol och syre är omvandlat.
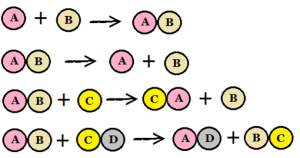
Bild: Oskar Uggla / UgglansNO
Kemiska reaktioner sker hela tiden överallt. En del reaktioner går blixtsnabbt till exempel explosioner medan andra tar väldigt lång tid på sig till exempel när järn rostar.
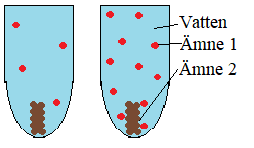
Vad påverkar reaktionshastigheten?
Bilden nedan visar två ämnen som reagerar med varandra i ett provrör med vatten. Vattnet reagerar inte utan hjälper bara ämne 1 och ämne 2 att stöta på varandra.
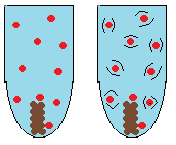
Koncentration – Om koncentrationen av ett eller fler av ämnena är hög kommer reaktionen gå snabbare. Det beror på att det finns fler aktiva atomer som kan stöta ihop med varandra och reagera.
Finfördelning – Ämnen som är uppdelade i småbitar reagerar snabbare med varandra. Reaktionen sker där ämnena har kontakt med varandra. Smulas ett ämne sönder till småbitar eller till pulver har det en mycket större area som kan komma i kontakt med det andra ämnet. Har ämnena större kontaktyta har de enklare att stöta på varandra och reagera.
Temperatur – Ju högre temperatur ett ämne har desto mer rör sig dess atomer. Ju snabbare atomerna rör sig desto större chans att stöta ihop med något annat ämne och reagera med.
En katalysator är ett kemiskt ämne som påskyndar en kemisk reaktion utan att själv förbrukas. Alla kemiska reaktioner har inte en katalysator och olika reaktioner (av de som kan påskyndas) har olika katalysatorer.
När ämnen reagerar med varandra frigörs nästan alltid värme (vid 95% av reaktionerna). Det innebär att de ämnen som reagerar innehåller mer energi än det som bildats. En av drivkrafterna till att ämnen spontanreagerar med varandra är att bilda energifattigare föreningar. Dessa reaktioner kallas exoterma .Till exempel när ved brinner. Eftersom ved är energirikare än aska.
Motsatsen kallas endoterm reaktion. Då kommer det bildas energirikare ämnen än vad som fanns från början. Vid dessa reaktioner tas värme upp från omgivningen. Värmen lagras som kemisk energi.
Fördjupning:
- Film – Top 10 Chemical reactions (Dailytop20s, engelska, 10.38)
- Film – 6 chemicals reactions that change history (It´s ok to be smart, engelska, 7.55)
- Film – Endothermic and exothermic reactions (Bozeman Science, engelska, 4.34)
- Film – Amazing chemicals reactions! (Youtube, engelska, 4.11)
- Film – Why do chemical react? (Ted-Ed, 3.46, Engelska)
- Film – How to speed up chemical reactions. (Ted-Ed, 4.56, Engelska)
Uppgifter:
KEMISKA FORMLER
 |  |
Kemiska reaktioner beskrivs med kemiska tecken. Kemiska tecken är en förkortning av grundämnens namn. I det periodiska systemet finns alla grundämnen med deras kemiska tecken samlade. Med hjälp av siffror i det nedre högra hörnet på det kemiska tecknet visas vilket antal atomer som finns i molekylen.
- 2 O betyder två syreatomer som är skilda från varandra. Tänk att du har en i varje hand.
- O2 betyder två syreatomer som sitter ihop.
- 2 O2 betyder två syremolekyler med två atomer var. Totalt fyra syreatomer.
- H2O står för en vattenmolekyl vilken består av två väteatomer och en syreatom.
- 2 H2O står för två vattenmolekyler.
Med kemiska formler beskrivs vad som händer vid en kemisk reaktion. Det finns en del regler att hålla sig till. Här är ett exempel när zink reagerar med syre.
Zn + O → ZnO
De ursprungliga ämnena står till vänster och det som bildas till höger. Använd plustecken och reaktionspil. Reaktionspilen visar vad som bildas. I de ursprungliga ämnena markerats antalet atomer med en siffra framför ämnet om det är två eller fler. Om antalet är ett skrivs endast det kemiska tecknet ut.
Det måste finnas lika många atomer på vardera sidan av reaktionspilen.
Vissa grundämnen (bara gaser) är ofta molekyler i sitt grundtillstånd. De sitter då ihop två och två. Till exempel syre (O2), väte (H2), klor (Cl2) och kväve (N2).
Hur döps kemiska föreningar?
Ämnen som innehåller syre slutar på ”oxid” till exempel kolmonoxid, CO och ämnen som innehåller svavel slutar på ”sulfid” till exempel Järnsulfid, FeS
Många andra ämnen får ändelsen –id. Till exempel klor blir klorid.
Ifall det är en styck av en atom sätts ibland ett ”mono” framför.
Ifall det är två stycken av en atomsort sätts ofta ett ”di” framför. CaCl2 heter kalciumdiklorid. Om det är tre stycken av en atomsort sätts ett ”tri” framför.
Ett lite svårare exempel:
H2+ O2 → H2O
Både väte och syre hänger ihop två och två i sin grundform. Räknar du atomerna på de olika sidorna ser du att det är olika antal syre. Nu får du tänka lite.
H2 + O2 → 2 H2O
Sätts en tvåa framför vattenmolekylen får vi två stycken vattenmolekyler. Totalt fyra väte och två syre på högersidan. Det stämmer fortfarande inte. Nu får du tänka lite till.
2 H2 + O2 → 2 H2O
Nu stämmer det: fyra väte och två syre på båda sidorna. Föreningen kallas diväteoxid men kallas vanligtvis för vatten.
Fördjupning:
- Hemsida –naturvetenskap.org: Reaktionsformler
- Film – naturlikt.se: Att skriva formler (youtube, svenska, 6.27)
- Kemiska formler – 9 små filmer med Oskar Uggla
Del1, Del2, Del3, Del4, Del5, Del6, Del7, Del8, Del9
Fördjupning:
- Film – Ämnens uppbyggnad (Andreas Sandqvist, svenska, 10.00)
- Film – Kemiska formler (Mc Matte, svenska, 7.39)
- Hemsida – Reaktionsformler (naturvetenskap.org)
- Kemiska formler – 9 små filmer med Oskar Uggla
Del1, Del2, Del3, Del4, Del5, Del6, Del7, Del8, Del9
Uppgifter:
 |  |  |  |  |