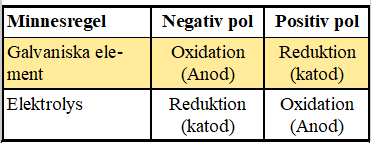
|  |
Elektrolys innebär att starta och driva kemiska reaktioner med elektricitet. Detta används för att framställa grundämnen (till exempel koppar och aluminium) samt för att skydda olika metaller mot nedbrytning (korrosion).
Till elektrolys behöver du två stavar som leder ström (metall- eller kolstavar) och en jonlösning. Stavarna kallas elektroder och jonlösningen elektrolyt. Det behövs också en strömkälla med likström. Det innebär att strömmen går i samma riktning hela tiden. På bilden visas en enkel uppställning.
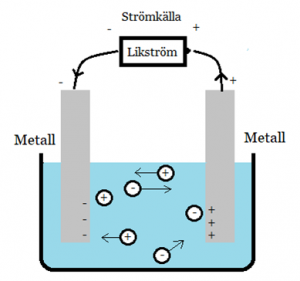
Bild: Oskar Uggla / UgglansNO
När en spänning läggs på, kommer i det här fallet den vänstra elektroden bli en minuspol och den högra en pluspol. De positiva jonerna dras till minuspolen och de negativa jonerna till pluspolen. Oxidation sker vid den positiva polen som kallas anod. Reduktion sker vid den negativa polen som kallas katod. Detta är tvärtom jämfört med galvaniska element. Minnesregeln för elektrolys är PANK. Positiv pol = Anod, Negativ pol = Katod
För både elektrolys och galvaniska element sker oxidationen vid anoden och reduktionen vid katoden.
Jonerna i jonlösningen lägger sig ofta som en beläggning på elektroderna. Bildas det gas bubblar det vid den elektroden. Om det bildas alkalimetaller, till exempel natrium, reagerar den genast med vattnet i jonlösningen och gör det basiskt.
Bild: Oskar Uggla / UgglansNO
Eftersom det finns en strömkälla som driver den kemiska reaktionen är det viktigt att elektroderna leder elektricitet bra. Därför är de båda ofta gjorda av koppar. Ibland finns det risk för att kopparelektroden oxideras d.v.s. att den själv blir till joner och vandrar ut i elektrolyten. Då kan man byta ut dem mot kolelektroder istället. Kol har molekylbindning och håller hårdare i sina elektroner. (Kopparen har metallbindning).
Med hjälp av elektrolys är följande möjligt:
- Att sortera jonerna i en jonlösning eftersom de åker till olika poler. Detta sker vid framställning av vissa metaller. Det går också att framställa gaser.
- Det går att lägga metallbeläggningar på andra metallföremål. Det kallas för att galvanisera och skyddar metaller som lätt korroderar till exempel spikar.
Fördjupning:
- Film – Electrolysis of molten compounds (Fuseschool, engelska, 4.04)
- Film – Electrolysis of water (Fuseschool, engelska, 4.07)
Uppgifter:
 |  |  |  |  |
Hjälp till att förbättra Ugglans NO! Har du hittat något fel, någon död/olämplig länk eller vill tipsa om någon intressant länk? Skriv en kommentar nedan.