 |  |
En jon är en atom som gett bort eller som tagit upp en eller flera elektroner för att uppnå fullt yttersta elektronskal.
Jonbindning är en bindning mellan två joner. För att en kemisk förening med jonbindning ska kunna bildas krävs det att en atom vill ge bort elektroner och att en annan atom vill ta upp dem. Den kemiska föreningen kallas för salt.
Den atom som ger bort elektroner blir en positiv jon och den atom som tar upp elektroner blir en negativ jon. Jonföreningar bildas oftast av grundämnen som står långt ifrån varandra i periodiska systemet.
Jonföreningar är vanligtvis sammansatta av en positiv jon och en negativ jon. De kan också bestå av en positiv jon och en negativ jon som består av flera sammansatta grundämnen.
Ta upp eller ge bort elektroner?
Vi börjar att titta på alkalimetallerna (gr. 1) som har en valenselektron. Om en alkalimetall blir av med den får den då fullt yttersta elektronskal (eftersom K-skalet, som blir kvar, innehåller två elektroner och då är det fullt.)

Bild: OskarUggla / UgglansNO ©
Om alkalimetallen blir av med en elektron försvinner en minusladdning. Den får fler positiva protoner än negativa elektroner. Alltså blir alkalimetaller positiva som joner. Samtliga alkalimetaller får laddningen 1+ som joner. Lägg de positiva och negativa laddningarna i en gammaldags våg så ser du att de positiva väger mest. Det blir överskott med en plusladdning.
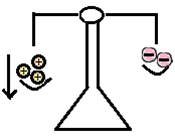
Bild: OskarUggla / UgglansNO ©
Grundämnena i grupp 2 har två valenselektroner. För att få ett fullt yttersta elektronskal behöva den ge bort dem. Då får atomen ett överskott på två plusladdningar. Därför får grundämnena i grupp två jonladdningen 2+.
Halogenerna (gr. 17) saknar en valenselektron för att uppnå fullt yttersta skal. De har sju men vill ha åtta valenselektroner. De tar upp en elektron någonstans ifrån för att uppnå fullt yttersta elektronskal. Ofta sker det vid en kemisk reaktion till exempel när ett salt bildas. När halogener gör detta får de fler negativa elektroner än positiva protoner. Halogener blir alltså negativa som joner. Samtliga halogener får laddningen 1- som joner.

Bild: OskarUggla / UgglansNO ©
- Grundämnena i grupp 16: till exempel syre, svavel. Saknar två valenselektroner och får oftast jonladdningen 2–.
- Grundämnena i grupp 13 har jonladdningen 3+och de i grupp 15 har jonladdningen 3–.
Övriga grundämnen är det svårt att lista ut jonladdningen på. Du får slå upp dem i en tabell.
Fördjupning:
- Film – Joner (Andreas Sandqvist, svenska, 7.27)
- Film – Jonbindningar (Urplay, 1.51, svenska)
- Film – Jonbindningar och jonföreningars egenskaper (Magnus Ehinger, 7.02, svenska)
- Film – Jonbindningar (Magnus Ehinger, svenska, 5.46)
- Film – Hur blir atomen en jon? (Studi, svenska, 4.03)
- Hemsida – Joner (org)
Uppgifter:
 |  |  |  |  |
Hjälp till att förbättra Ugglans NO! Har du hittat något fel, någon död/olämplig länk eller vill tipsa om någon intressant länk? Skriv en kommentar nedan.

