 |  |
Korrosion innebär att en metall löses upp genom en kemisk reaktion. Vanligtvis reagerar metall med syre och bildar då metalloxider. Utomhus går reaktionen snabbare och det händer olika saker beroende på metall. Några exempel:
- Järn rostar till olika varianter av järnoxid. Järnoxid är poröst och har det väl börjat rosta går det ganska snabbt för resten av järnet att reagera.
- När aluminium reagerar med syre får metallen en hinna av aluminiumoxid. Detta lager skyddar mot många reaktioner till exempel med syre vilket gör att aluminium håller sig fint länge så släng därför inga aluminiumburkar i naturen.
Bild: DEZALB / Pixabay License
- Koppar ärgar och blir vackert grön. Tänk på hur fina gamla kyrktak kan vara. Det kallas ärga när koppar reagerar med luftens syre och bildar ett lager kopparoxid på metallens yta. Likt exemplet ovan med aluminium skyddar den metallen mot fler reaktioner. Det tar det lång tid för kopparen att brytas ner i naturen.
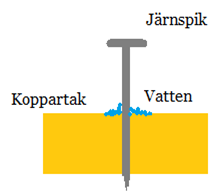
Bild: Oskar Uggla / UgglansNO
Om metaller blandas är det möjligt att omedvetet bygga galvaniska element som gör att metaller löses upp (korroderar). Ett klassiskt exempel är att använda järnspik för att spika ett koppartak. Regnvattnet kommer bli en jonlösning. Det gör att järnet (som är oädlare än koppar) kommer avge elektroner till kopparen och järnet försvinner iväg som joner. Järnet löses upp.
För att skydda sig mot korrosion orsakad av elektrokemi sätts oädla metaller dit på utsatta metallföremål.
Bild: Bros / Creative Commons 3.0 International
Ungefär 3,5 procent av havsvattnet består av joner. Det gör havsvattnet till en jonlösning. En metallbåt kommer alltid riskera att korrodera när ädlare joner snor elektroner från båtens skrov. Därför sätts en väldigt oädel metall fast i skrovet till exempel magnesium. Magnesiumet kommer att lösas upp i första hand. Magnesiumet kallas offeranod. När det sedan är slut får man sätta dit nytt. Denna typ av skydd används också när metalltankar grävs ner i jorden, till exempel på bensinstationer.
Ytterligare ett sätt att skydda metaller som lätt reagerar med syre är att dra över ett lager med en metall som är mindre reaktionsbenägen. Till exempel doppas järnspikar i flytande zink. Det kallas för att de varmförzinkas.

Fördjupning:
- Film – Korrosion (Magnus Ehinger, 6.08, svenska)
- Film – Corrosion of metals (Fuseschool, engelska, 2.52)
- Film – What is corrosion and how to stop it (GCSE Chemistry, engelska, 6.19)
- Film – Rust: Preventation & Treatment (Fuseschool, engelska, 4.51)
- Film – Corrosion and rust (elearnin, engelska, 2.14)
- Film – Varför rostar järn och hur kan man förhindra det? (Le3scienteers, svenska, 9.03)
Uppgifter:
 |  |  |  |  |
Hjälp till att förbättra Ugglans NO! Har du hittat något fel, någon död/olämplig länk eller vill tipsa om någon intressant länk? Skriv en kommentar nedan.



