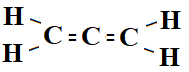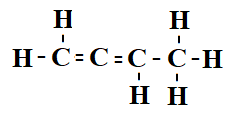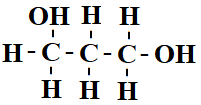|  |  |  |  |
DET UNIKA KOLET
 |  |
Kolets kemi kallas för organisk kemi. Kemi som inte innehåller grundämnet kol kallas för oorganisk kemi.
Det som gör grundämnet kol speciellt är att det kan binda upp till fyra andra atomer samtidigt och bilda långa kedjor och ringar. Andra grundämnen kan vanligtvis binda till en, två eller möjligtvis tre andra atomer.

Dessutom kan kol bilda en mängd olika strukturer. Molekylerna med kol kan vara raka, grenade eller ha formen av en ring. Molekylernas storlek kan vara från några atomer till flera tusen. Det finns nästan oändligt många olika sätt att bilda molekyler som innehåller kol.
En kemisk bindning innebär att atomer dras till varandra (attraheras) på grund av deras elektriska laddning. Detta gör att atomer sitter ihop och bildar kemiska föreningar.
Vad gör kol så intressant?
- Kol är förutsättningen för liv. Alla levande organismer innehåller kol. Utan kolets egenskaper hade det troligtvis inte funnits liv på jorden eftersom inget annat grundämne kan ersätta kolet.
- Av de omkring 20 miljoner kemiska molekyler som upptäckts innehåller 95 % av dessa grundämnet kol.
- Kolet spelar en huvudroll i jordens viktigaste kemiska reaktion, fotosyntesen. Fotosyntesen omvandlar solens strålningsenergi till socker (kemisk energi). Utan fotosyntesen är liv på jorden omöjligt. All den mat vi människor äter har sitt ursprung i fotosyntesen.
- Nästan alla föremål som människan använder innehåller kol. Både naturliga ämnen som till exempel trä, kläder och papper men också konstgjorda till exempel plast.
- Det mesta av allt bränsle som används idag innehåller kol. Både när det gäller uppvärmning av hus eller bränsle till fordon. Kemisk energi lagras i kemiska föreningar med kol.
Ett av dagens stora miljöproblem handlar om koldioxidhalten i atmosfären. Den ökande koldioxidhalten orsakas bland annat av förbränning av bränslen som innehåller kol.
Foto: ColiN00B / Pixabay License
Fördjupning:
- Film – Grundämnet kol (Studi, svenska, 3.04)
- Film – Grundämnet kol (Fröken Ulle, svenska, 3.10)
- Hemsida – kol (periodiskasystemet.nu)
- Artikel – Kol – var fanns det från början? (Naturhistoriska museet)
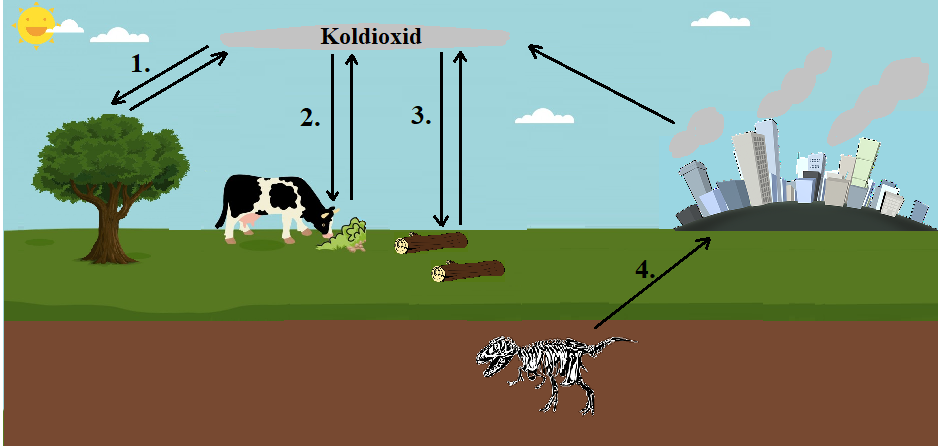
KOLETS KRETSLOPP
 |  |
De grundämnen som finns på jorden har funnits här sedan solsystemets skapelse. Inga grundämnen försvinner och inga nya tillverkas. Naturligtvis tillförs lite grundämnen av meteoriter och en del har skickats ut i rymden av människan. Ett fåtal, ytterst kortlivade, grundämnen (med de högsta atomnumren) har tillverkats i laboratorium. I det stora sammanhanget är det så lite att det inte spelar någon roll.
En del av jordens grundämnen och kemiska föreningar rör sig i olika kretslopp. Ett kretslopp beskriver hur ämnet cirkulerar i naturen. Till exempel börjar vattnets kretslopp i havet. Vattnet avdunstar till molnen för att sedan regna ner och blir till floder, för att sedan återigen hamna i havet. Därefter börjar det om.
Eftersom kolet är ett sådant vanligt ämne har det flera olika kretslopp som tar olika lång tid. Det som alltid finns med i kolets kretslopp oavsett variant är fotosyntes och förbränning.
Kolets kretslopp startar med att kol binds till en organism genom att koldioxiden i atmosfären ingår i fotosyntesen. För att kolet ska återvända till atmosfären krävs någon typ av förbränning. Den tar olika lång tid. Eldar du upp ett par vedträn eller låter dem ligga i skogen, så att de förmultnar, sker samma kemiska reaktion men den tar olika lång tid. Vid reaktionen frigörs den kemiska energi som finns i det ursprungliga druvsockret som tillverkades vid fotosyntesen.
OskarUggla / UgglansNO ©
Exempel:
- En dag – En växt tar upp kol genom fotosyntesen. För att få energi till att leva förbränner växten druvsocker omedelbart. När växter och djur har förbränning kallas det cellandning.
- En dag -100 år – En växt tar upp kol genom fotosyntesen. Ett djur äter upp växten. När djuret använder energi genom cellandningen och andas ut kolet återgår det till atmosfären. Kanske kolet används till att bygga upp djuret. Då återgår kolet till atmosfären när djuret dör.
- 100 – 1000 år – Ett träd tar upp kol genom fotosyntesen. Kolatomen kommer att ingå i trädets cellulosa som bygger upp stammen. Kolet återgår till atmosfären när träden dör och förmultnar.
- 100 miljoner år – En skog tar upp och binder kol genom fotosyntesen. Genom speciella omständigheter hamnar det organiska materialet under marken där det sakta omvandlas till fossilt bränsle till exempel olja, naturgas eller stenkol. Kolet återgår till atmosfären när det förbränns till exempel i en bilmotor eller för att värma upp ett hus.
Fördjupning:
- Film – Energiflöde och kretslopp (Andreas Sandqvist, svenska, 8.58)
- Film – Kolets kretslopp (Magnus Ehinger, 4.32, svenska)
- Hemsida – Kolets kretslopp (naturvetenskap.org)
- Artikel – Kolets kretslopp rubbas (Naturvårdsverket)
- Film – The carbon cycle (Ted-Ed, 3.55, Engelska)
- Film – Kolets två kretslopp (Urplay, 2.14, svenska)
- Film – Kolets kretslopp (Magnus Ehinger, 4.32, svenska)
- Faktablad – Vattnets kretslopp och fotosyntesen (Naturskyddsföreningen)
- Film – The carbon cycle (Ted-Ed, 3.55, Engelska)
RENT KOL
 |  |
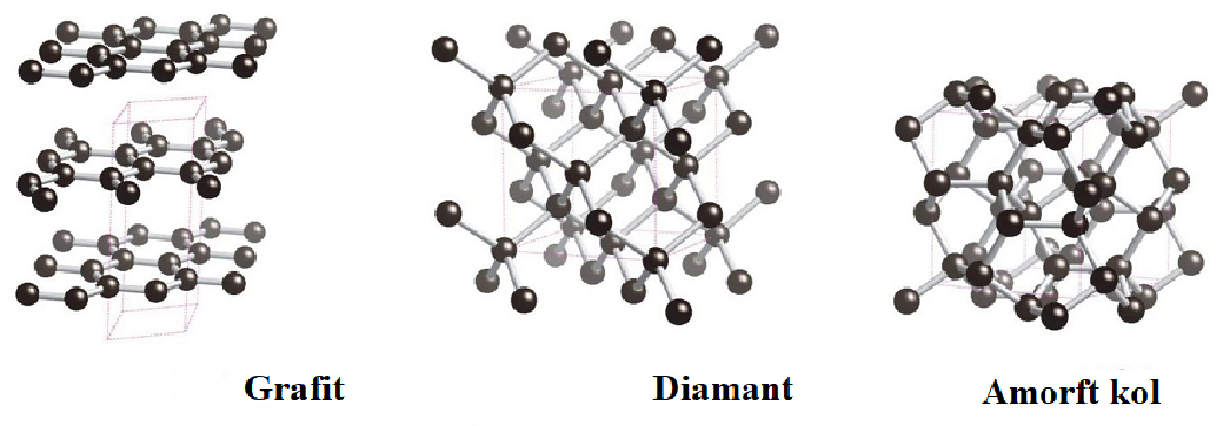
Kol är ett vanligt grundämne och på jorden finns det både i ren form och i en uppsjö av kemiska föreningar. Skillnaden mellan de olika sorterna av rent kol är hur kolatomerna är strukturerade, det vill säga hur de binder sig till varandra. Kolets rena former i naturen är:
Amorft kol: Amorft kol kallas kol där kolatomerna inte sitter i mönster eller i någon regelbunden struktur. Exempel på detta är träkol (grillkol) som innehåller nästan 100 % rent kol. Stenkol är en bergart som innehåller 90 % rent kol.
Aktivt kol är ett amorft kol som används flitigt både i hemmet och på sjukhuset. Aktivt kol innehåller många porer (håligheter). I porerna fastnar lätt andra ämnen. Aktivt kol används därför för att rena luft till exempel i ventilationssystem och i gasmasker. Om du får i dig giftiga ämnen används aktivt kol för att förhindra förgiftning.
Grafit: I grafit sitter kolatomerna i skikt. Det finns starka bindningar i varje plan men svaga bindningar mellan planen. Det gör att det är enkelt att skrapa av ett lager. Du blir helt enkelt smutsig om du tar i grafit. Sot består till största delen av grafit.
- Grafit leder elektricitet och används i elektronik.
- Grafit används som smörjmedel.
- Kolfiber består av grafit. Kolfiber som gjuts in i plast blir ett mycket lätt och starkt material (en komposit). Det kan användas till fiskespön, karosser till olika typer av fordon och sportredskap till exempel racket.
- Grafit används i blyertspennor.
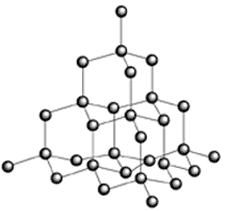
Diamant: I en diamant sitter kolatomerna med samma avstånd från varandra i en symmetrisk jättemolekyl. Den regelbundna formen gör diamant till naturens hårdaste ämne. Genom att upphetta grafit under hårt tryck går det att tillverka diamanter. Förutom till smycken används diamanters hårda egenskaper i borrar och skärverktyg. Ett av världens mest berömda reklamcitat är ”Diamonds last forever”. Det är inte sant. Eftersom diamant är kol reagerar det med luftens syre och bildar koldioxid om det upphettas tillräckligt mycket.
Bild: AlexanderAlUS / CC BY-SA 3.0
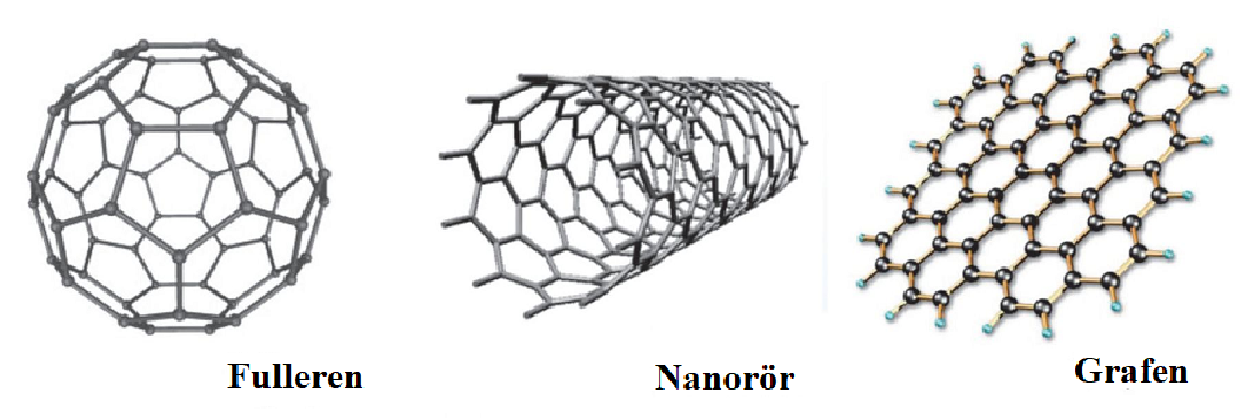
Flera nya former av rent kol har upptäckts och upptäckterna har gett Nobelpris, fulleren (kemi 1996) och grafen (fysik 2010). Fulleren ser ut som fotbollar och består av ungefär 70 kolatomer. Nanorör är en variant av fulleren där formen är ett rör. Grafen kan beskrivas som ett skikt av grafit. Det är genomskinligt och ungefär 200 gånger starkare än stål, men det är mycket lättare. Det är formbart, leder elektricitet och är ogenomträngligt för gaser och vätskor.
Grafen och fulleren kommer garanterat att användas i många framtida projekt till exempel genomskinliga skärmar och effektiva solceller.
Fördjupning:
- Film – Andreas Sandqvist: kolets kemi (youtube, svenska, 8.34)
- Hemsida – sophiessilver.se: Mohs hårdhetsskala
- Artikel – Forskning och framsteg (svårt) : 10 sätt att använda grafen
- Hemsida – Sandviken Coromant : Grafen – Ett material som kan förändra världen
- Film – Graphehe: The next wonderful material? (Chem-matters, 5.09, engelska)
- Film – Nanotechnologys big impact (Chem-matters, 7.15, engelska)
- Film – Graphen: The next tech revolution (Chem-matters, 2.29, engelska)
- Film – What is graphene? (Chem-matters, 1.41, engelska)
METANSERIEN
 |  |
Grunden i organisk kemi är kolväten. De enklaste kolvätena består bara av kol och väte. De mest avancerade kan innehålla flera tusen kolatomer och även flera andra olika grundämnen.
Återigen, kolets förmåga att binda fyra andra atomer och förmågan att bilda kolkedjor som är grenade eller ogrenade samt kolringar gör att det finns nästan oändligt många sätt att bilda molekyler som innehåller kol.
Det logiska system som finns för att sortera och namnge alla dessa föreningar kallas för organisk nomenklatur.
Atomer sitter ihop med kemiska bindningar. Bindningarna får atomerna att bilda kemiska föreningar. Det finns olika typer av bindningar. Inom den organiska kemin markeras bindningarna genom ett streck mellan atomerna.
Eftersom kolatomen alltid har fyra bindningar och kan binda upp till fyra andra atomer finns det alltid fyra streck från kolatomen som visar dessa bindningar. Viktigt är att kolet alltid har fyra bindningar, aldrig fler och aldrig färre.
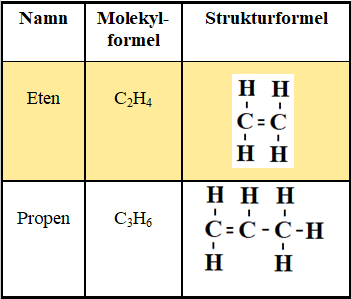
Alkaner
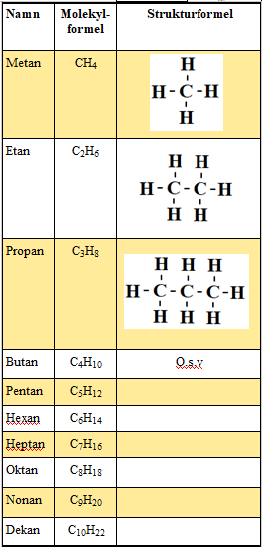
De minst komplicerade kolvätena kallas alkaner. De tio enklaste alkanerna radas upp i metanserien. Metanserien är grunden för all namngivning av kolväten.
- Ändelsen på varje kolväte visar vilken typ av kolväte det är. I metanserien slutar alla med ändelsen -an. Ett samlingsnamn för alla kolväten som slutar på -an är alkaner.
- Den kemiska formeln för kolväten kallas molekylformel. Den visar vilka grundämnen molekylen innehåller och hur många av varje sort.
- Strukturformeln visar hur molekylen är uppbyggt i en platt variant. I verkligheten är molekylen i tre dimensioner.
Fördjupning:
- Film – Kolväten (Andreas Sandqvist, 9.46, Svenska)
- Film – Hydrocarbon power (Crashcourse, engelska, 11.31)
- Film – kolväten och verkligheten (Naturlikt.se, svenska, 3.18)
ISOMERER
 |  |
Raka eller grenade kolväten
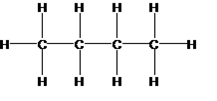
Ett kolväte kan ha samma molekylformel men olika strukturformel. Kolvätet på bilden ovan heter butan och har en rak kolkedja. Det innebär att kolatomerna sitter på rad.
När butan har en rak kolkedja kallas det också normalbutan eller bara n-butan. N-butans molekylformel är C4H10.
När ett kolväte har samma molekylformel men en annan strukturformel kallas det för isomer.
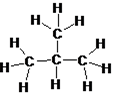
Varianten av butan ovan har samma molekylformel (C4H10 ) men en annan strukturformel.
Den har en grenad kedja och kallas för iso-butan.
N-butan och isobutan har liknande egenskaper men skiljer sig åt när det gäller kokpunkt och smältpunkt.
Av butan finns det bara två olika varianter. Vid stora organiska molekyler finns det många isomerer. Det är en av anledningarna till att det finns så många olika organiska föreningar. När kolvätena blir mer avancerade kan de också döpas på ett mer avancerat sätt än bara normal och iso.
Mättade och omättade kolväten
Alkaner, som endast har enkelbindningar, är mättade kolväten. Det betyder att det endast finns en bindning mellan kolatomer i molekylen. Mättade kolväten binder så många väteatomer som det är möjligt.
Om ett kolväte har en eller flera dubbelbindningar eller trippelbindningar kallas de omättade kolväten. Det betyder att det finns dubbla eller trippla (3st) bindningar mellan kolatomerna i molekylen.
Omättade kolväten har enklare att reagera med andra ämnen. När de omättade kolvätena reagerar med andra ämnen kan de bli mättade.
Kunskapen om mättade och omättade fetter är något som används för att beskriva hur nyttig mat är. Omättade fetter är nyttigare fetter som det är bra för hälsan att välja framför mättade fetter.
Bild: FotoshopTofs / Pixabay License
Fördjupning:
- Film – 2 isomerer av pentan (Peter Ringh, svenska, 9.10)
ALKENER & ALKYNER
 |  |
Alkener – dubbelbindning
En kolatom kan binda en annan kolatom med två bindningar. Bindningen kallas för dubbelbindning. Samlingsnamnet för kolväten med en eller flera dubbelbindningar är alkener. De har ändelsen -en. Nedan är exempel på de två enklaste alkenerna. Resten av metanserien följer samma mönster.
Ett kolväte kan ha flera dubbelbindningar. Det markeras i namngivningen. Bilden nedan föreställer propen med två dubbelbindningar. Den heter därför prop-di-en.
På alkener med längre kedjor markeras dubbelbindningens placering med en siffra. Numreringen sker från den ände där dubbelbindningen är närmast änden. Detta kolväte kallas 1,2-butdien.
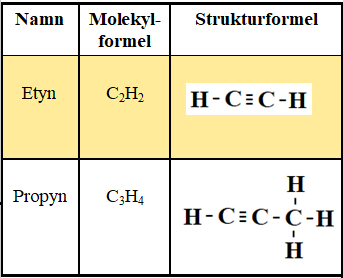
Alkyner – trippelbindning
En kolatom kan binda en annan kolatom med tre bindningar. Bindningen kallas trippelbindning. Dessa kolväten kallas alkyner. De har ändelsen -yn. Nedan är exempel på de två enklaste alkynerna. Resten av metanserien följer samma mönster.
På samma sätt som hos alkener kan kolväten ha fler trippelbindningar. Om butyn skulle ha två stycken trippelbindningar skulle det heta butdiyn. På kolväten med flera kolatomer kan positionen av trippelbindningen markeras med en siffra. Nedan: 1,3-butdiyn.
Både alkener och alkyner är omättade kolväten. Deras dubbel- och trippelbindningar kan brytas upp och binda fler atomer till exempel väte, syre och klor. Samma kolförening kan innehålla både enkel-, dubbel– och trippelbindningar.
Fördjupning:
- Film – Kolväten (Andreas Sandqvist, svenska, 9.45)
- Hemsida – Alkener och alkyner (Naturvetenskap.org)
ALKOHOLER
 |  |
Alkohol förknippas med öl, vin och sprit. Dessa drycker innehåller alkoholen etanol. Det finns dock betydligt fler sorters alkoholer än bara etanol. I kemin är det en speciell grupp av kolväten. De har gemensamt att de har minst en hydroxigrupp, en OH-grupp. Alkoholernas namn slutar alltid med ändelsen -ol.
Grundämnet syre kan binda två andra atomer i en organisk molekyl. De kan också ha dubbelbindning. I alkoholer har syret enkelbindning och finns mellan en kolatom och en väteatom. För att tydligt markera att det är en alkohol skrivs vanligtvis inte ”strecket” för bindning ut mellan syret (O) och vätet (H).
Alla dessa alkoholer har en OH-grupp. Då kallas alkoholen envärd. Har alkoholen två OH-grupper kallas den tvåvärd och har den tre OH-grupper kallas den trevärd.
För att tydligt visa att det är en alkohol skrivs molekylformeln med OH-gruppen i slutet av strukturformeln. Molekylformeln kan också skrivas med grundämnena i bokstavsordning. Propanol blir då C3H8O.
Om alkoholen är tvåvärd eller trevärd markeras det med räkneorden di eller tri. Med hjälp av en siffra markeras på vilka kolatomer OH-gruppen sitter. Denna alkohol skulle heta 1,3 -propandiol.
Metanol

Metanol är giftigt och varje år dör människor för att de dricker metanol i tron att det är etanol. Metanol kan göra dig blind i mindre mängder.
Det finns alltid en risk att smuggelsprit innehåller metanol. Metanol kallas också träsprit. Den används även vid tillverkning av plaster och som bränsle i fordon.
Etanol

Etanol är en av människans vanligaste droger. Den är naturligtvis också giftig och vid stort eller långvarigt drickande är den dödlig. Etanol används också för tillverkning av plaster och som bränsle till bilar och bussar.
Glykol

Glykol är en tvåvärd alkohol som används till bilens kylare. Den sänker fryspunkten för vattnet i kylaren så det inte fryser till is en kall vinterdag. Molekylformeln är C2H4(OH)2. OH-gruppen sätts inuti en parentes. Tvåan som sätts efter nertill innebär att det är två stycken av OH-gruppen.
Fördjupning:
- Film – Andreas Sandqvist: Alkoholer (youtube, svenska, 9.16)
- Film – Alkoholer (Magnus Ehinger, 8.17, svenska)
- Hemsida – Alkoholer (Naturvetenskap.org)
KARBOXYLSYROR OCH ESTRAR
 |  |
Organiska syror
Bild: Johanna84 / Pixabay License
Organiska syror innehåller kol och är vanliga i naturen. De finns i växtriket (till exempel oxalsyra, askorbinsyra och citronsyra) samt i djurriket (till exempel myrsyra och mjölksyra). Organiska syror kallas också för karboxylsyror, eftersom de innehåller en karboxylgrupp, -COOH. I tabellen nedan visas de tre enklaste karboxylsyrorna.
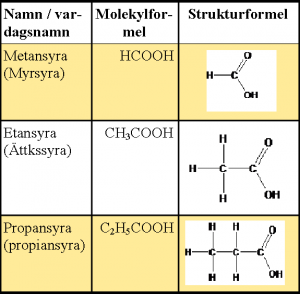
- Organiska syror kallas ibland för fettsyror eftersom de kan ingå i fetter.
- Alla organiska syror är svaga syror.
- Det kan ingå fler karboxylgrupper i syran.
- De slutar alltid med -syra.
Ester
Bild: stevepb / Pixabay License
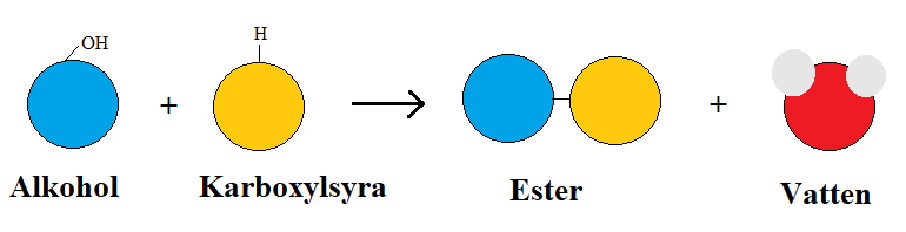
Estrar är en grupp av kolväten som luktar. Dessa kemiska lukter finns naturligt i till exempel frukt men kan också tillverkas genom en kemisk reaktion.
När en alkohol och en syra blandas försvinner de frätande och giftiga egenskaperna och i vissa fall uppstår en trevlig lukt. I andra fall uppstår en otrevlig lukt eller ingen lukt alls.
Alkohol + Syra → Ester + Vatten
Vid reaktionen försvinner både alkoholen och syran och den ofarliga estern bildas. Estrar är vanliga lukt- och smakämnen i godis, glass och läsk. Estrar fungerar också som lösningsmedel och finns i målarfärg.
En känd ester är nitroglycerin. Den skapas genom en reaktion mellan salpetersyra och glycerol. Nitroglycerin används som sprängmedel och som hjärtmedicin.
Fördjupning:
- Film – Andreas Sandqvist: Organiska syror och estrar (youtube, svenska, 7.37)
- Film – Karboxylsyror (Magnus Ehinger, 11.53, svenska)
- Hemsida – Karboxylsyror (Naturvetenskap.org)
- Hemsida – Estrar (Naturvetenskap.org)
FORMELSKRIVNING VID FÖRBRÄNNING
 |  |
När ett ämne som innehåller kol, brinner reagerar det med luftens syre och bildar koldioxid och vatten. Ibland finns det föroreningar uppblandade med kolvätet som gör att det bildas fler ämnen. I råolja finns till exempel ofta lite svavel.
Den kemiska formeln för förbränning är lika för alla kolväten.
Kolväte + Syre → Energi + Koldioxid + Vatten.
Några grundregler vid formelskrivning är:
- Det ska finnas lika många atomer av varje grundämne på vardera sida om reaktionspilen.
- För att balansera formeln sätts siffror framför de kemiska föreningarna. Det är inte tillåtet att förändra de små siffrorna som tillhör den kemiska föreningen.
- Alla siffror måste vara heltal.
- En tvåa framför ett grundämne eller kemisk förening innebär att det är två stycken av det. Sitter det en liten tvåa nertill vid ett kemiskt tecken är det bara detta grundämnet det är två av.
Jämför 2 CO (2 kol och 2 syre) med CO2 (1 kol och 2 syre)
Nedan förklaras hur du balanserar formler när kolväten förbränns. Exemplet handlar om metan, CH4.
Metan + Syre → Energi + Koldioxid + Vatten.
____CH4 + ___O2 → ___CO2 + ___H2O
1. Börja med att skriva upp den formeln för förbränning. Skriv i det kolväte du ska balansera.
2. Undersök antalet kol på båda sidor av pilen. I detta fall är det samma antal. Hade det inte varit det hade du varit tvungen att sätta en siffra framför någon av molekylerna med kol i.
3. Undersök antalet väte. I detta fall är det fyra väteatomer på vänstra sidan och två på högra sidan av pilen. Sätt därför en tvåa framför vattenmolekylen.
____CH4 + ___ O2 → ___CO2 + 2 H2O
4. Undersök slutligen antalet syreatomer. På den vänstra sidan är antalet syreatomer två. På högersidan av pilen är antalet fyra. Sätt därför en tvåa framför syremolekylen på vänster sida.
5. Nu stämmer formeln. Lika många atomer av varje grundämne på vardera sida om reaktionspilen.
CH4 + 2 O2 → CO2 + 2 H2O
Bild: Pontus Wallstedt / UgglansNO ©
Fördjupning:
- Film – Hur man balanserar kemiska reaktionsformler (Magnus Ehinger, svenska, 14.49)
- Film – Kemiska tecken och formler (SwedenAcademy, svenska, 5.18)
- Film – Enkla reaktionsformler (SwedenAcademy, svenska, 5.18)
- Simulator – Balancing chemical equations (Phet)
FOSSILA BRÄNSLEN
 |  |
Ett fossilt bränsle kommer ursprungligen från organismer som på något sätt hamnat i jordskorpan och under lång tid koncentrerats på grund av trycket i jordskorpan.
Förbränningen av fossila bränslen bidrar till ökad koldioxidhalt i atmosfären och en förstärkt växthuseffekt. De fossila bränslena är inte förnybara och kommer att ta slut i framtiden. De kommer dock att räcka i flera hundra år till.
Människan använder de fossila bränslena till uppvärmning, produktion av elektricitet och bränslen till fordon med mera. En del förädlas till exempel till plast.
Olja
Bild: Pontus Wallstedt / UgglansNO ©
Den råolja som pumpas upp ur marken innehåller 100-tals olika slags kolväten. Eftersom kolvätena har olika användningsområden är det en poäng att sortera dem. Det görs genom användning av en metod som kallas fraktionerad destillation. Detta sker i oljeraffinaderier. Alla typer av kolväten har olika kokpunkt och det är den egenskapen som utnyttjas när de ska sorteras.
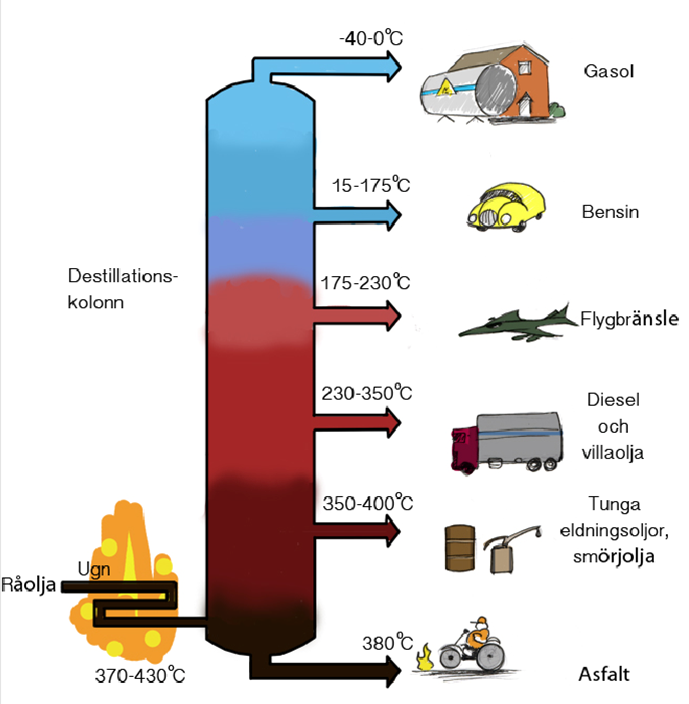
Bild: Pontus Wallstedt / UgglansNO ©
Naturgas
Naturgas består av en blandning av de enklaste kolvätena, mestadels metan. Gasen transporteras i långa pipelines.
I Sverige används lite naturgas. En del av den används för att driva bussar eftersom naturgas är renare än diesel. Globalt kommer 20 procent av all energi från naturgas. Mycket av Europas naturgas kommer i pipelines från Ryssland. En ledning går utanför Gotland. Att bli beroende av rysk naturgas i Europa är en viktig politisk fråga.
Torv, brunkol och stenkol
Bild: orensteiner / Pixabay License
Torv består av delvis förmultnade växtdelar, mestadels vitmossa. Torven innehåller runt 65 procent kol och kan användas som bränsle. Efter 1000-tals år förvandlas torven till brunkol och blir till sist stenkol. Ju längre tid som går desto högre kolhalt. Både brunkol och stenkol är sedimentära bergarter.
Fördjupning:
- Hemsida – Fossila bränslen (Naturvårdsverket.se)
- Hemsida – Fakta om kol (se)
- Hemsida – Fossila bränslen (El.se)
- Hemsida – Kolkraft (El.se)
- Hemsida – Oljekraft (El.se)
- Hemsida – Gaskraft (El.se)
BRÄNSLEN FÖR FORDON
 |  |
Bild: andreas160578 / Pixabay License
Bensin är det i särklass vanligaste drivmedlet idag. Bensin är en blandning av flytande kolväten med 5-10 kolatomer. För att kunna utvinna tillräckligt med bensin räcker det inte att separera råoljan, en teknik som kallas crackning används också. Vid crackning slås längre kolkedjor sönder så att de blir lagom långa för att vara bensin.
Diesel är ett drivmedel som används mer och mer. Diesel innehåller kolväten med 10-22 kolatomer. Dieselbilar har ofta lägre bränsleförbrukning än bensinbilar eftersom diesel har högre energiinnehåll än bensin. Dieselbränsle innehåller mer kol per liter än bensin så koldioxidutsläppet blir lite högre. Dieselfordon släpper ut fler farliga partiklar än bensinfordon.
Etanol kan tillverkas av olika slags grödor eller restprodukter och avfall, är ett förnybart bränsle som ger minskade utsläpp av koldioxid och en mindre klimatpåverkan. Energiinnehållet i etanol är 30 procent lägre än i bensin vilket gör att en bil som går på E85 (85 % etanol och 15 % bensin) har högre bränsleförbrukning. Bränslekostnaden blir därför inte lägre än med bensin. Framställningen av etanol är inte nödvändigtvis miljövänlig. Ifall åkermark för grödor används till produktionen innebär det att matproduktionen minskar. Användningen av etanol (E85) har minskat mycket. Istället är vanlig bensin blandad med 5-10 procent etanol.
Fordonsgas består av metangas i form av naturgas, biogas eller en blandning av båda. Eftersom naturgas är ett fossilt bränsle och biogas ett förnybart bränsle blir miljöpåverkan olika beroende på vilket som används.
Biodiesel är ett drivmedel som kemiskt liknar vanligt diesel men som är ett förnybart bränsle. Biodiesel är biologiskt nedbrytbart och inte giftigt.
Elektricitet: En elbil drivs naturligtvis inte av ett fossilt bränsle. Beroende på hur elen produceras kan bilen ändå indirekt använda fossila bränslen. En elbil är inte renare än dess energikälla. En stor del av elbilens miljöpåverkan beror på tillverkningen och hanteringen av batteriet. Bilar som drivs av el, som är tillverkade av förnybara energikällor, bidrar inte till växthuseffekten eller belastar miljön i samma utsträckning som andra bilar. Nackdelen med elbilar är dels att inköpspriset är högt samt att räckvidden inte är lika lång som hos motsvarande diesel– och bensinbilar. Det behövs helt enkelt bättre batterier.
En hybridbil har flera bränslen. Oftast bensin i kombination med el, etanol eller fordonsgas.
De bilar som säljs flest av idag i Sverige (nyregistrerade 2022) är elbilar eller elhybrider.
Det mest miljövänliga är naturligtvis att inte äga en bil över huvud taget.
Bild: dimitrisvetsikas1969 / Pixabay License
Fördjupning:
- Film – Fossila bränslen (Andreas Sandqvist, svenska, 9.35)
- Hemsida – Drivmedel – olika bränsletyper (korkortonline.se)
- Hemsida – Bilar och bränslen (Motormännens riksförbund)
 |  |  |  |  |